Stoffwechsel-Umleitung eröffnet neue Wege der CO2-Fixierung
Neuer synthetischer Stoffwechselweg ist eine Alternative zur pflanzlichen Photorespiration
Die pflanzliche Photorespiration ist ein Prozess, der Energie kostet und bei dem bereits fixiertes CO2 wieder frei wird. Dieser Stoffwechselprozess gilt daher als ein wichtiger Ansatzpunkt zur Verbesserung von Ernteleistungen und zur Senkung des steigenden CO2-Gehalts der Atmosphäre. Forschende um Prof. Dr. Tobias Erb vom Max-Planck-Institut für terrestrische Mikrobiologie haben nun den TaCo-Stoffwechselweg entwickelt, einen synthetischen Bypass zur Photorespiration. Er eröffnet neue Möglichkeiten der CO2-Fixierung und der Produktion wertvoller Kohlenstoff-Verbindungen.
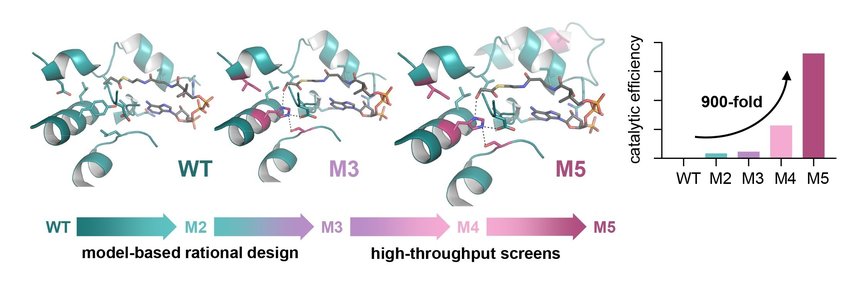
Engineering der Glycolyl-CoA-Carboxylase (GCC), dem Schlüsselenzym des TaCo-Wegs. GCC wurde basierend auf dem Gerüst einer natürlich vorkommenden Propionyl-CoA-Carboxylase (WT) entwickelt. Rationales Design führte zu der 50-fach verbesserten Version M3, und zusätzliches Hochdurchsatz-Screening ermöglichte die Identifizierung einer 900-fach verbesserten Version (M5). Max-Planck-Institut für terrestrische Mikrobiologe/Scheffen
Alles Leben auf der Erde ist auf die Fixierung von CO2 durch Pflanzen angewiesen. Die Effizienz der natürlichen Photosynthese ist jedoch begrenzt, was die landwirtschaftlicheProduktivität und die CO2-Fixierung erheblich einschränkt. Die Photorespiration ist ein Entgiftungsprozess, der ein toxisches Nebenprodukt der Photosynthese, 2-Phosphoglykolat, recycelt. Dieser Prozess ist sehr energieaufwändig und führt zur Freisetzung von zuvor fixiertem CO2, was die photosynthetische Bilanz weiter verschlechtert.
Forschende um Prof. Dr. Tobias Erb vom Max-Planck-Institut für terrestrische Mikrobiologie haben einen synthetischen Stoffwechselweg entwickelt, mit der die Photorespiration umgangen werden kann. Mit dem sogenannten Tartronyl-CoA (TaCo)-Weg hat das Team in Zusammenarbeit mit der Gruppe von Dr. Arren Bar-Even (MPI für Molekulare Pflanzenphysiologie, Potsdam-Golm) und im Rahmen des EU-geförderten Projekts Future Agriculture einen Weg entworfen, der viel kürzer ist als die natürliche Photorespiration und nur fünf statt 11 Enzyme benötigt. Der vielleicht größte Vorteil des TaCo-Wegs ist, dass er CO2 fixiert, anstatt es freizusetzen, wie es bei der natürlichen Photorespiration geschieht. Dadurch ist der TaCo-Weg energieeffizienter als jeder andere bisher entwickelte photorespiratorische Bypass.
Der Aufbau des TaCo-Wegs war eine wissenschaftliche Reise, die die Forschenden vom theoretischen Modell über enzymatisches Engineering, mikrofluidisches High-Throughput-Screening und Kryo-EM-Technologie zur erfolgreichen In-vitro-Implementierung einer in der Natur neuartigen Stoffwechselverbindung geführt hat. “Die größte Herausforderung bei der Realisierung des TaCo-Stoffwechselwegs war es, alle benötigten Enzyme zu finden – wir mussten nach Enzymen suchen, die ähnliche Reaktionen katalysieren, und diesen dann die gewünschte Reaktion `beibringen`,” erinnert sich Marieke Scheffen, Postdoc in der Gruppe von Tobias Erb und Erstautorin der Studie.
Effizientere Enzyme
Für den TaCo-Weg wurden zunächst eine Handvoll Enzyme gefunden, die in der Lage waren, die benötigten Reaktionen zu katalysieren. Allerdings zeigten sie eine zu geringe katalytische Effizienz, das heißt, sie waren im Vergleich zu natürlich vorkommenden Enzymen recht langsam. Die Forscher wollten vor allem die Leistung des Schlüsselenzyms des TaCo-Wegs steigern, der Glycolyl-CoA-Carboxylase (GCC), dem Katalysator, der die Photorespiration kohlenstoffpositiv macht.
Als Grundlage für die Herstellung einer synthetischen Glycolyl-CoA-Carboxylase (GCC) entwickelten die Forschenden ein molekulares Modell des Enzyms. Ausgehend von einer natürlich vorkommenden Propionyl-CoA-Carboxylase, die normalerweise am Fettsäurestoffwechsel beteiligt ist, wurden durch den Austausch von einzelnen Aminosäuren verschiedene Varianten des Enzyms geschaffen. Diese Designstrategie führte zu einer 50-fachen Verbesserung der katalytischen Effizienz des Enzyms mit dem Substrat Glycolyl-CoA.
Um die Leistung des Enzyms noch weiter zu steigern, arbeiteten die Forschenden mit der Gruppe von Jean-Christophe Baret vom französischen Nationalen Zentrum für wissenschaftliche Forschung (CNRS, CRPP) in Bordeaux zusammen, mit der sie einen mikrofluidischen Ultra-Hochdurchsatz-Screen entwickelten und Tausende von synthetischen Varianten testeten. Innerhalb von zwei Runden Mikrotiterplatten-Screenings wurde eine Enzymvariante gefunden, die eine fast 900-fach erhöhte katalytische Effizienz mit Glycolyl-CoA zeigte. “Mit dieser katalytischen Effizienz liegt GCC im Bereich der natürlich vorkommenden biotinabhängigen Carboxylasen. Das heißt, wir konnten aus einem Enzym mit praktisch keiner Aktivität gegenüber Glycolyl-CoA eines mit sehr hoher Aktivität entwickeln, die mit natürlich entstandenen Enzymen vergleichbar ist”, erklärt Marieke Scheffen.
Hochauflösende Elektronenmikroskopie
Die Aufklärung der molekularen Struktur dieses neu entwickelten Katalysators gelang in einer weiteren Zusammenarbeit mit Jan und Sandra Schuller vom Max-Planck-Institut für Biochemie, Martinsried (heute SYNMIKRO in Marburg). Die Forscher setzten modernste kryogene Elektronenmikroskopie (Kryo-EM) mit einer atomaren Auflösung von 1,96 Å ein und überschritten damitdie Grenzen der Kryo-EM. In den anschließenden in-vitro-Experimenten erwies sich das synthetische GCC-Enzym in Kombination mit den beiden anderen synthetischen Enzymen des TaCo-Weges als funktionsfähig und bildete somit den Kern eines anwendbaren Kohlenstoff-Fixierungsweges. “Der TaCo-Weg ist nicht nur eine vielversprechende Alternative zur Photorespiration”, sagt Gruppenleiter Tobias Erb. “Wir konnten auch zeigen, dass er mit anderen synthetischen CO2-Fixierungszyklen, wie dem CETCH-Zyklus, gekoppelt werden kann. Damit können wir die synthetische CO2-Fixierung direkt und effizient mit dem zentralen Stoffwechsel verbinden.”
Dies eröffnet eine Reihe von wissenschaftlichen Möglichkeiten, zum Beispiel in Richtung des Recyclings von Polyethylenterephthalat (PET). Der TaCo-Weg könnte in Zukunft dazu genutzt werden, um Ethylenglykol (ein Monomer von PET) direkt in Glycerat umzuwandeln und es so für die Produktion von Biomasse oder wertschöpfenden Verbindungen nutzbar zu machen. Der nächste Schritt wird sein, die in vivo-Implementierung voranzutreiben, um das volle Potenzial des neu entwickelten Weges auszuschöpfen.
Originalveröffentlichung
Scheffen, M.; Marchal, D.G.; Beneyton, T.; Schuller, S.K.; Klose, M.; Diehl, C.; Lehmann, J.; Pfister, P.; Carrillo, M.; He, H.; Aslan, S.; Cortina, N.S.; Claus, P.; Bollschweiler, D.; Baret, J.-C.; Schuller, J.M.; Zarzycki,J.; Bar-Even, A.; Erb, T.J.
A new-to-nature carboxylation module to improve natural and synthetic CO2 fixation
Nature Catalysis 1 (2021)
Source: Max-Planck-Institut für terrestrische Mikrobiologie, Pressemitteilung, 2021-01-04.
